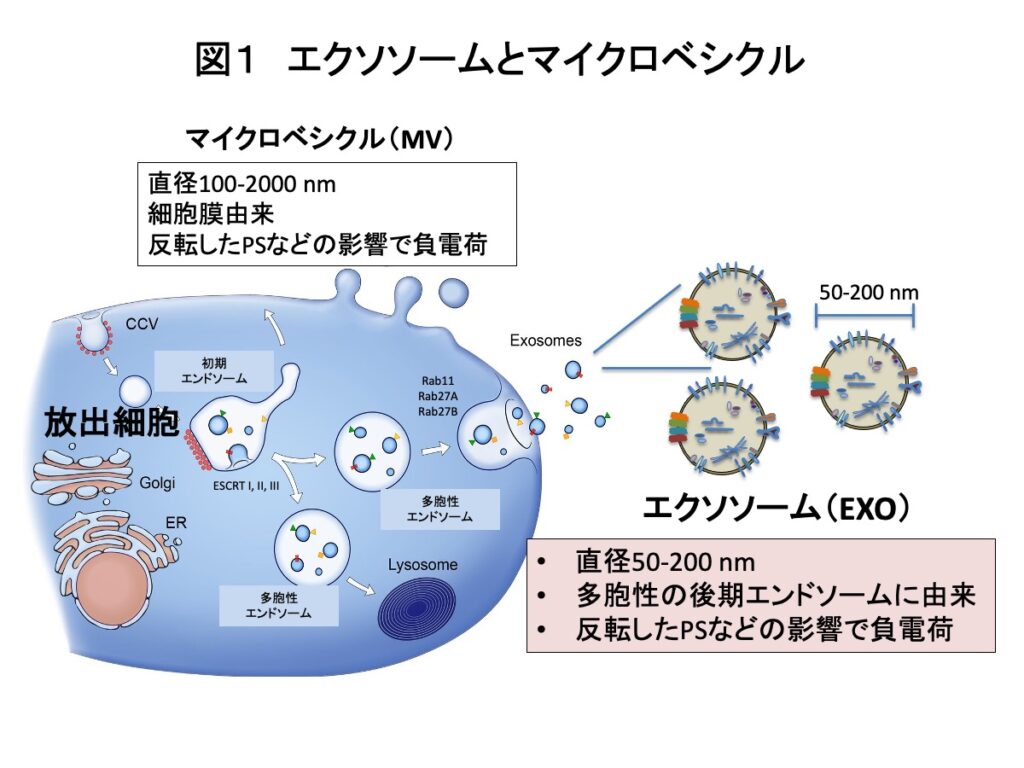
あらゆる細胞は、細胞外小胞(EV: Extracellular vesicle)と呼ばれる細胞を包む膜(原形質膜:一般には細胞膜と呼ぶ)と同様の脂質二重膜で形成される小胞を放出する。EVには大きく分けて、後期エンドソームの内腔側にできる多胞を起源とする直径50-200 nmのエクソソーム(EXO: Exosome)と、細胞膜を起源とする直径100-2000 nmのマイクロベシクル(MV: Microvesicle)がある(図1)。どちらのEVも放出細胞の生理活性物質を包含し、放出されると近場や遠隔の標的細胞に取り込まれ、その生理活性物質で標的細胞の形質を変化させことができるため、細胞間の情報伝達役として近年注目を集めている。
ある細胞のEV機能を知りたい場合には、その細胞の培養上清を超高速遠心することで得られる沈渣中のEVを用いるのが一般的だが、この方法では、EXOとMVを区別できず、不要な凝集タンパク質なども含まれるため、不純物を除いた高い純度でEXOとMVを分けて調製する方法の開発がEV研究分野の大きな課題となっている。我々は最近、EXOとMVの粒子の大きさと負電荷の違いを利用したEVの調製法を開発し、世界初となる大量の培養上清から超高純度でEXOとそれ以外のEVを分ける技術を開発した(図2)。
臓器にできるがんは、進行の過程で線維芽細胞などの間質細胞(固形がんでは、がん細胞からなる領域を実質、その他の細胞からなる領域を間質と呼ぶ)を味方につけながら悪性化し、原発巣から漏出し遠隔の組織に転移するようになる。我々は、がんの免疫学的拒絶の中心として働く細胞傷害性T細胞(CTL: cytotoxic T lymphocyte)の放出するEXOが、がん組織に対してどのような作用を持つのかについて、CTLの大量の培養上清から図2の方法でEXOを調製し検討した。その結果、CTL EXOは、がん細胞には取り込まれず、線維芽細胞をはじめとした間質細胞に大量に取り込まれ、それら間質細胞を死滅させることでがんの浸潤や転移を抑えていることが明らかとなった(図3:Nature Communications 9: 435, 2018)。現在、CTL EXOがなぜ線維芽細胞に優先的に取り込まれるのか、そして取り込まれた後に線維芽細胞を傷害する分子メカニズムは何か、等々について研究を継続している。
CTL EXOによるがんの間質細胞傷害は、がんの浸潤や転移の阻害と直結するため、CTL EXOをがん進行阻害剤として臨床応用するための創薬的な開発研究も始まっている。具体的には、1)常に同じ品質のCTL EXOを大量に作製するための、閉鎖系培養およびEXO調製システムの開発、2)CTL EXOを間質細胞のみならずがん細胞にも特異性を持たせるための活性補強技術の開発、3)CTL EXOの長期安定性の検討や保存法の開発、4)CTL EXOの安全性に関する検討、等々について進行中である。
(文責:瀬尾)



 TOP
TOP