(背景)
生体内で抑制状態にあるT細胞の再活性化を目的とした抗PD-1(Programmed Death-1)抗体に代表される抗チェックポイント抗体による新規がん免疫療法が、悪性黒色腫・肺癌・胃癌・大腸癌など各種の癌でこれまでに見られなかった治療効果を挙げています。この薬剤の作用機序として、生体内で抑制状態にあった「腫瘍を認識し傷害するT細胞」が再活性化され、腫瘍を攻撃できるようになるため治療効果が得られると考えられています。その際、これらT細胞がT細胞受容体(TCR)を介してどのような抗原を認識し腫瘍細胞を傷害しているのかが重要となりますが、様々な癌種におけるこれまでの報告からは腫瘍特異的な遺伝子変異数の多さがこれら治療法の効果と相関していることが明らかとなっています。まだ今後の検証を必要としますが、これらの結果からは、活性化し腫瘍縮小効果をもたらすT細胞が腫瘍特異的な遺伝子変異に起因する変異抗原を認識している可能性が強く示唆されており、実際にヒト/マウスモデルにおいて変異抗原に特異的なT細胞のがん治療での有効性が報告されています。
このような背景から、腫瘍に対する生体のT細胞免疫応答、とりわけ変異抗原に対する生体の免疫応答に関する知見を深め理解することが、今後の更に有効ながん免疫療法開発にとって極めて重要であると考えられるようになっています。
(研究内容)
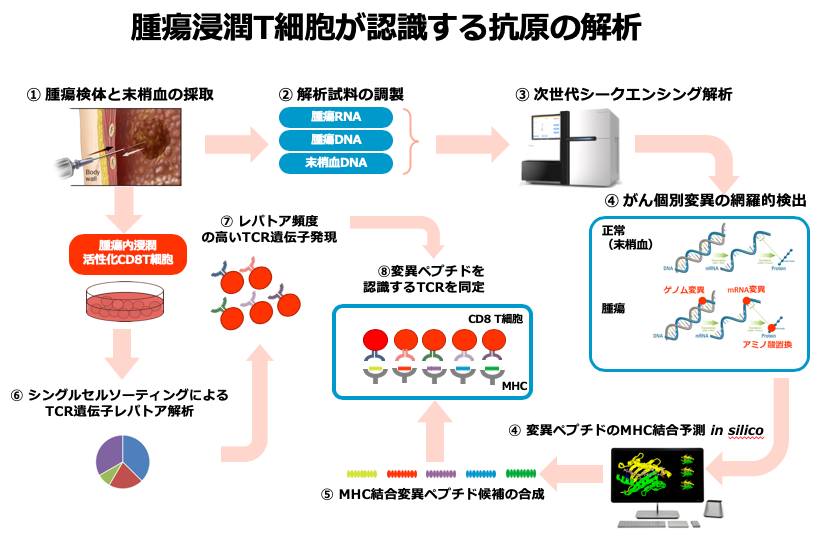
我々の研究室では、腫瘍に反応することが期待される「腫瘍局所浸潤T細胞(TIL)」を中心に、どのようなTCRを持つT細胞が浸潤しているのか、そして腫瘍を認識し傷害するT細胞が実際に変異抗原を認識しているのかについて研究を進めています。この研究では、富山大学・東京大学・企業との共同研究を行っています。具体的には、個々のT細胞からのTCR遺伝子の取得、TCRレパトア解析及びレトロウイルスによるTCR発現を行う技術を確立しています。また、次世代シークエンスを利用した免疫原性の高い腫瘍特異的変異抗原のより効率的なin silicoでの同定法開発を開発中であり、腫瘍反応性が期待されるTIL中でのレパトア頻度の高いTCRを対象に、実際に変異抗原を認識しているのかについて検討を進めています。現在、胃がん・大腸がん・乳がんを対象とするTIL解析を中心とした臨床研究を開始しています。



 TOP
TOP