- がんワクチンは、腫瘍特異的抗原に由来するワクチン抗原をがん患者に繰り返し投与することで腫瘍特異的免疫応答を体内に誘導し、これを腫瘍抑制に利用することを原理としている(図1)。多くの場合、がんワクチンはワクチン抗原、アジュバント、デリバリーシステムの3成分で構成される。近年、以下に示す種々の成分を組み合わせた多様ながんワクチンが登場し、国内外で広く臨床評価されている。
- ワクチン抗原:腫瘍細胞に特異的に発現する抗原蛋白に由来するペプチドや組換え蛋白、またはこれらをコードする核酸(mRNA・DNA)が利用されるが、腫瘍細胞自体を用いることもある。
- アジュバント:従来から用いられている金属塩やサポニン、サイトカインに加えて、強力な自然免疫賦活化作用を示すToll様受容体(TLR)や細胞内DNA/RNAセンサー(STINGやRIG-I等)のアゴニストが注目されている。
- デリバリーシステム:エマルジョン型の不完全フロイントアジュバントが最も広く用いられているが、最近ではリポソームや生物ベクター(バクテリアやウイルス)の活用も進んでいる。
- ワクチン抗原:腫瘍細胞に特異的に発現する抗原蛋白に由来するペプチドや組換え蛋白、またはこれらをコードする核酸(mRNA・DNA)が利用されるが、腫瘍細胞自体を用いることもある。
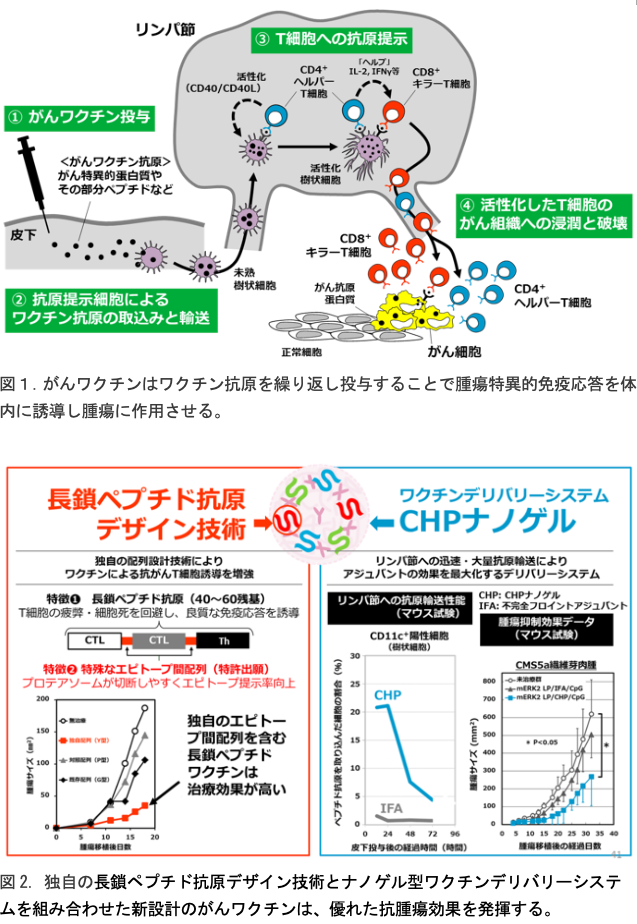
- 我々は、腫瘍特異的免疫応答の誘導能力に優れた高性能がんワクチンの設計技術の樹立を目指し、様々なワクチン抗原、アジュバント、デリバリーシステムを検討してきた。その結果、ワクチン抗原として「長鎖ペプチド抗原」、アジュバントとして「TLRアゴニスト」、そしてデリバリーシステムとして「CHPナノゲル」の組合せが最も有用であることを見出した(図2)。
- 長鎖ペプチド抗原は、化学合成で製造可能な数十残基のペプチドである。その中に複数のT細胞エピトープを含有させることができ、多様なT細胞応答の誘導が可能である。短鎖ペプチド抗原で懸念される免疫寛容誘導の可能性もない。ただし、長鎖ペプチド抗原はいわゆるプロドラッグであり、樹状細胞やマクロファージ等の抗原提示細胞に取り込まれたあとに、長鎖ペプチド抗原に含まれるT細胞エピトープが適切に切り出される必要がある。我々は、長鎖ペプチド抗原上のT細胞エピトープ間のアミノ酸配列(「エピトープ間配列」)に着目し、抗原提示細胞内で効率よく切断されるエピトープ間配列を複数同定した。この長鎖ペプチドデザイン技術を用いることで、長鎖ペプチドワクチンによるT細胞の安定した誘導が可能になる(図2左)。
- がんワクチンは皮下、皮内または筋肉内投与されることが多いが、いずれにしても、がんワクチンが投与後にリンパ節に効率良く移行することが、その後の特異的免疫応答誘導に大変重要であることが明らかとなってきた。我々はこれを実現するワクチンデリバリーシステムを京都大学との医工連携で模索し、独自の高分子マテリアルである「コレステリルプルラン(CHP)」にその能力があることを見出した。CHPはコレステロール基で修飾した多糖プルランであり、生理的条件下で自発的にナノサイズのゲル、すなわちナノゲルを形成する。その内部にワクチン抗原を容易に包埋することが可能であり、長鎖ペプチド抗原を包埋したCHPナノゲルを動物に皮下投与したところ、迅速かつ高効率に近傍リンパ節に移行することを見出した。このリンパ節移行は細胞非依存的なプロセスであった。リンパ節内ではCHPナノゲルは、これまであまり研究されていない「髄質マクロファージ」に選択的に取り込まれることも発見した。髄質マクロファージはTLRアゴニストの存在下で、強力なクロスプレゼンテーション能力を発揮する。CHPナノゲルは、髄質マクロファージ指向型という特性から、他とは異なる非常にユニークなワクチンデリバリーシステムとしており、がんワクチンの免疫誘導能力向上に大きく貢献する(図2右)。
- 以上の長鎖ペプチド抗原、デリバリーシステム、アジュバントから成る高性能がんワクチンを新たに設計し、その実用化研究を鋭意推進している。



 TOP
TOP