がんワクチン
(背景)
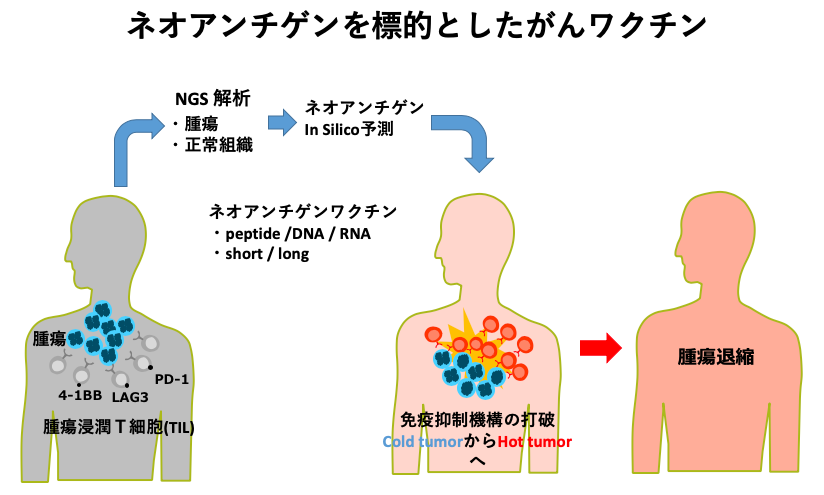
抗チェックポイント抗体を用いた免疫療法の臨床での成功によって、「がんに対する免疫応答が増強されれば腫瘍の退縮に結び付けることが可能である」ことが明確になってきました。これまでにも、がんに特異的な免疫応答を活性化させるために腫瘍抗原を標的とした短鎖ペプチド・長鎖ペプチド・蛋白・DNA・mRNA等を用いたがんワクチン臨床研究が世界各国で行われてきましたが、効果は満足できるものではありません。そのため、現在はより治療効果を上げるために、これらがんワクチン療法と抗チェックポイント抗体等の他の免疫療法との複合免疫治療が活発に行われています。また、これまではワクチンの標的抗原としてがん精巣抗原・分化抗原等が用いられてきましたが、近年には個々のがんゲノムの変異に由来する変異抗原(ネオアンチゲン)を標的とした個別化がんワクチンの有効性に期待が持たれるようになってきました。
(研究内容)
免疫療法の中でも、がんワクチン療法では投与する抗原(単価あるいは多価を含め)に対する免疫応答を生体内に誘導することで治療効果に結び付けることを目的としています。従って、ワクチンの性能を判定する上で、実際に投与した抗原に特異的なT細胞がどの程度誘導されるかを正確に評価することが極めて重要となります。しかし、免疫応答解析の対象として一般的に用いられる末梢血中では誘導される抗原特異的なT細胞の頻度が低く、通常では数日間から数週間の培養を行い抗原特異的T細胞の頻度を飛躍的に増幅させる手技が必要となります。このような長期間の培養を伴う場合では、培養後に得られる抗原特異的T細胞の頻度等の解析結果が実際に生体内に惹起された免疫応答をどこまで正確に反映しているかが不明確であり、ワクチンの正確な性能評価をすることが困難であることが大きな課題となっていました。
この問題を克服する一つの手段として、私たちの研究室では培養時間を最小限にすることを可能とする、従来の測定法と比較してより鋭敏なCXCR3リガンドCXCL9,10を指標とする免疫応答検出法の開発を行いました。ヒト及びマウス免疫系を用いた解析により、微量のIFN-gの存在下でもこれらケモカインが多量に産生され、より重要な点として、免疫応答の非常に早期にこれらケモカインの産生が十分に認められることが分かりました。現在、この測定法を用いてがんワクチン療法の免疫応答解析を行うとともに、変異抗原をワクチン標的とした様々な形態の個別化がんワクチン療法の開発に向けた取り組みを行っています。



 TOP
TOP